口腔大全
Ti-75合金对人成骨细胞的生长、增殖和功能分化的影响
Ti-75合金对人成骨细胞的生长、增殖和功能分化的影响
研究Ti-75合金对人成骨细胞生长、增殖和功能分化的影响。方法:将传至第5代的人成骨细胞接种于Ti-75合金表面进行培养,在不同培养时间进行细胞计数,计算细胞贴壁率,绘制细胞生长曲线,检测细胞裂解产物中的碱性磷酸酶(ALPase)活性和蛋白质含量。结果:培养于Ti-75合金表面的人成骨细胞在24 h贴壁率达到84.38%,细胞ALPase活性和蛋白质合成量在培养第7天后出现明显增大趋势,各项指标同作为对照组的纯钛相比,均无显著差异。结论:Ti-75合金具有与纯钛相同的良好骨组织生物相容性,适于作为骨内种植材料应用。
关键词:种植材料;成骨细胞;细胞培养
在生物材料领域中,钛及钛合金以杰出的生物相容性和良好的耐腐蚀性等优点,占据了非常重要的地位。Ti-75合金是中国西北有色金属研究院近年研制出的一种新型钛合金,其强度介于纯钛和Ti-6Al-4V之间,不含钒,机加工性能优于纯钛,是作为骨内种植的良好备选材料。近年来,由于细胞培养和分化提纯技术的研究进展,为观察骨细胞和生物材料的相互作用提供了一个有效的手段〔1〕,应用细胞培养的方法,建立骨一种植体界面的体外模型,对成骨细胞在种植材料表面的吸附、分化等表达特点进行研究,使在细胞和分子水平上研究生物材料与生物组织的相互作用成为可能。本研究即是采用上述方法,研究Ti-75合金对人成骨细胞的生长和功能分化的影响,以评价Ti-75合金作为骨内种植材料应具有的骨组织生物相容性〔2〕。
1 材料和方法
1.1 实验材料
Ti-75合金、TA2纯钛(西北有色金属研究院提供);人成骨细胞(本院中心实验室提供)等。
1.2 实验方法
1.2.1 试件处理 Ti-75合金及TA2加工成直径15 mm,厚1 mm的圆片试件,经喷砂、清洗后,高温高压消毒,分别置于经放射线消毒的24孔细胞培养板中。整个操作过程中均以钛钳夹持试件,防止异种元素污染。
1.2.2 成骨细胞贴壁率的测定 d=15 mm的Ti-75和TA2试件分别放于24孔培养板中,接种传至第5代的人成骨细胞,接种密度: 4×104个/ml,每孔加入0.5 ml。DMEM培养液中含有体积分数(φ)为10%胎牛血清、50 μg/ml L—抗坏血酸。放入二氧化碳培养箱37 ℃,饱和湿度,φ(CO2)=5%培养。分别于培养 1、2、8、24 h后各取出3个孔,去除细胞培养液,0.01 mol/L PBS清洗3次,2.5 g/L胰酶0.25 ml /孔消化3 min,加0.25 ml细胞培养液中和胰酶,细胞计数板计数细胞,每孔重复4次,取平均值。贴壁率计算公式为:贴壁细胞数/接种细胞数×100%。
1.3 成骨细胞生长曲线的测定
d=15 mm的 Ti-75和TA2试件放于 24孔培养板中,接种传至第5代的人成骨细胞,接种密度:2×104个/ml,每孔加入0.5 ml,培养液同前。分别于1、4、7、10 d各取出 4个孔,进行细胞计数,绘制生长曲线。
1.4 成骨细胞功能、分化指标检测。
细胞培养方法同1.3,接种后第1天始,每3 d换液一次,取4、7、10、14 d4个点进行培养,每时间点4个孔,用于制备细胞裂解液。制备细胞裂解产物: 吸去培养液,0.01 mol/L PBS清洗细胞3次,细胞裂解液(体积分数为0.02%Triton X-100,0.3 mmol/L PBS, pH7.2~7.4)200 μl,4 ℃下放置24 h。
1.4.1 细胞层碱性磷酸酶(ALPase)活性测定 细胞裂解产物100 μl加入反应底物(对硝基苯磷酸盐PNPP,Mg2+) 150 μl, 37 ℃孵育30 min,加入0.4 mol/L NaOH 100 μl终止反应,酶联免疫仪检测吸光度值,波长为410 nm。
1.4.2 细胞层蛋白质含量测定 细胞裂解产物20 μl加显色液(50 g/L考马斯亮蓝 G250、φ(乙醇)=2.375%、42.5 g/LH2PO4)200 μl,混合均匀10 min,酶联免疫仪测定吸光度值,波长为595 nm。
2 结 果
2.1 Ti-75合金表面成骨细胞贴壁率的测定
接种于Ti-75合金表面的人成骨细胞在前2 h的贴壁率为45.31%,到 24 h贴壁率达到84.38%(图1)。与TA2相比,在各个培养时间的细胞贴壁率二者无明显差异。
2.2 细胞生长曲线
Ti-75与TA2表现出近乎相同的生长特点,培养第1天,细胞数为1.51×104,至第7天,细胞增长为3.31×104个,第 10 d时,细胞数达到8.23×104个。(图2)。
2.3 细胞的功能分化指标
细胞 ALPase活性和蛋白质合成量由吸光度值表示。从图3、4可看出,上述指标在培养第7天后出现明显增大趋势。

图1 不同培养时间Ti-75和TA2表面成骨细胞的贴壁率培养时间
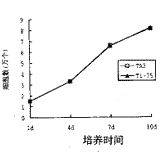
图2 Ti-75及TA2表面人成骨细胞生长曲线培养时间
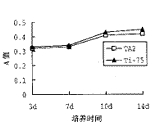
图3 Ti-75及TA2表面细胞层ALPase活性培养时间
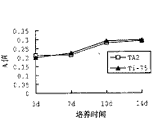
图4 Ti-75及TA2表面细胞层蛋白质含量
- 牙髓炎吃了布洛芬睡一觉好了?急性牙
- 德国树脂补牙材料和美国3M树脂补牙
- 做种植牙有哪些优缺点
- 美白镶烤瓷牙可能会伤神经
- 牙齿矫正会一直疼痛吗?牙齿矫正就诊
- 做种植牙有哪些步骤
- 牙齿美容四步走
- 那些情况下的乳牙需要拔除
- 宝宝有牙渍 易患牙龈炎
- 茶渍牙怎么治疗
- 种植牙使用年限有多久
- 哪三种情况需要做烤瓷牙
- 二氧化锆全瓷牙好吗
- 推荐几种美白牙齿的方法
- 做了烤瓷为何刷牙还要出血
- 牙齿烤瓷牙危害一般有哪些
- 烤瓷补牙有哪些优点
- 烤瓷牙的配色统计
- 单颗后牙种植(视频)
- 烤瓷牙护理需要注意哪些问题呢?
- 关于关注牙齿健康从小做起的问题
- 牙齿种植疗程可望大幅缩短
- 成人畸形牙正畸难度大?
- 奥林匹克公园 烤瓷牙哪里比较好
- 广西蓝天口腔怎么样?是专注口腔问
- 阜阳牙科医院价格表:含牙齿矫正\
- 以色列种植体系列有哪些?怎么选?本文
- 鄠邑区牙科哪家好?西安海涛口腔与
- 东海整牙好的医院排名:贝可口腔/微
- 东海牙齿矫正哪家好?贝可口腔/芮萌
- 沈阳种植牙齿哪家医院好?米兰口腔|
- 东海县的口腔医院价格表:种植牙500
- 阿坝看牙哪家便宜还靠谱?统计当地五
- 四平整牙箍牙要多少钱?传统金属/隐
- 乐山便宜又正规牙科有哪些?良心推荐
- 为您找到了!地包天牙齿矫正的较佳年
- 谁知道深圳港龙口腔收费如何?看这份
- 贵阳种植牙多少钱一颗?2024种植牙价
- 求解矫正牙齿3万块钱贵吗?一般都是
- 北京诺美口腔2024价格表参考,吸附性
- 抚顺牙科医院2024价格表更新:种植牙
- 2024新疆种植牙、矫正牙齿、牙齿美
- 韩国sg种植体怎么样?有哪些型号?有四
- 湘潭唯雅口腔特色项目收费公开,种植
- 韩国多普勒与奥齿泰种植牙对比:哪个
- 西安周至县哪个牙科比较好?对比海
- 北京诺美口腔怎么样?国内连锁品牌+
- 问:佳木斯牙齿矫正价格多少钱?答:2024